Vaksiner: produksjon og godkjenning
Martina Feichter studerte biologi med et valgfag apotek i Innsbruck og fordypet seg også i en verden av medisinske planter. Derfra var det ikke langt til andre medisinske emner som fortsatt fengsler henne den dag i dag. Hun utdannet seg til journalist ved Axel Springer Academy i Hamburg og har jobbet for siden 2007 - først som redaktør og siden 2012 som frilansskribent.
Mer om -ekspertene Alt -innhold kontrolleres av medisinske journalister.
Vaksiner brukes for din egen og andres beskyttelse: De kan forhindre deg i å bli syk selv og muligens smitte andre. Les her hvilke typer vaksiner det finnes, hvordan de lages og hvordan de må bevise deres effektivitet og sikkerhet!

Hva er vaksiner?
Vaksiner er medisiner som skal gjøre kroppen immun mot visse patogener. Så du kan beskytte mot infeksjon, og derfor snakker man om vaksinasjon.
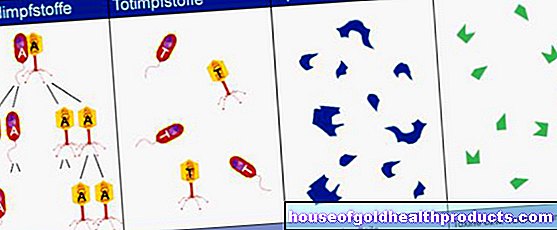
Eksperter klassifiserer vaksiner i henhold til forskjellige kriterier. Det skilles mellom levende vaksiner og døde vaksiner i henhold til levedyktigheten eller evnen til patogenene som er inneholdt for å reprodusere. Du kan lese mer om dette i artikkelen "Levende og døde vaksiner".
Rekombinante vaksiner inneholder en genetisk konstruert og spesielt typisk komponent i et patogen (subenhet antigen). Hvis såkalte vektorvirus (levende, men ikke sykdomsfremkallende virus) bærer dette typiske antigenet på overflaten, snakker noen eksperter om en rekombinant levende vaksine.
Genbaserte vaksiner introduserer bare den genetiske planen for et patogenets antigener i kroppen. Ved å bruke disse instruksjonene, bør kroppen deretter produsere de fremmede antigenene selv, som til slutt utløser en immunrespons. Disse typer vaksiner inkluderer DNA- og mRNA -vaksiner, så vel som vektorvaksiner. De ble først godkjent mot Covid-19 (vaksinasjon mot koronavirus).
Hvordan lages vaksiner?
Normalt dyrkes de relevante patogenene i stor skala for produksjon av vaksiner. Disse blir deretter behandlet, helt eller delvis, til en vaksine. Det er også noen vaksiner som inneholder antigener av et patogen produsert ved hjelp av genteknologi eller deres plan.
Utviklingsmåte
Vaksineutvikling foregår vanligvis i flere trinn:
- Analyse av det respektive patogenet og identifisering av et egnet antigen som fremkaller en immunrespons
- Undersøkelse og definisjon av vaksinens "design" (død eller levende vaksinasjon? Hele patogener eller komponenter i dem? Bruk av genteknologi?)
- Omfattende tester i laboratoriet, for eksempel på dyr, og deretter på mennesker; Som før legemiddelgodkjenning, foregår disse i tre faser. Forskere tester dosering, toleranse og immunrespons på flere og flere frivillige.
- Godkjenningsprosedyre hos vaksinasjonsmyndigheten
Vaksinasjonen bør alltid utløse en stabil immunrespons, som ideelt sett gir bedre og lengre immunforsvar enn selve infeksjonen. Dette må imidlertid ikke føre til en overdreven defensiv reaksjon som til slutt ville gjøre mer skade enn godt. I vaksineutvikling er også vaksinenes toleranse viktig.
Å lage en vaksine
Selve vaksinen produseres på følgende måte:
- Dyrking av patogenene som vaksinen skal virke mot, eller genteknologi av de ønskede antigenene eller den passende antigenplanen
- "Høsting" av antigenene, for eksempel virus fra cellekulturer eller antigener fra gjærceller, eller den genetiske planen og påfølgende behandling
- Tilskudd av andre komponenter, f.eks. For å styrke vaksinasjonseffekten (adjuvanser), og sammenslåing av komponentene i kombinasjonsvaksiner
- Tapping og emballasje
Dyrking av patogener
Patogenene som kreves for produksjon av vaksiner mot bakterielle smittsomme sykdommer (som meningokokker, tyfusbakterier) kan dyrkes direkte i næringsmedier. Disse kulturmediene gir patogenene alt de trenger for å overleve og formere seg. De blir deretter behandlet til en vaksine i flere trinn.
Produksjonen av vaksiner mot virale smittsomme sykdommer (som influensa, meslinger, kusma, røde hunder) er mer komplisert fordi virus bare kan formere seg i levende celler. For dyrking av den enorme mengden patogener som kreves for vaksineproduksjon, trenger man derfor levende vertsceller:
Kyllingegg
Kyllingegg brukes tradisjonelt for å dyrke virus: noen virus ("frøvirus") injiseres i et befruktet kyllingegg, som deretter inkuberes i en inkubator. I løpet av denne tiden formerer patogenene seg inne. Etter noen dager blir de isolert i komplekse prosesser og behandlet til en vaksine.
Kyllingeggene som brukes er ikke vanlige egg som er egnet til konsum og er tilgjengelig i dagligvarebutikker. I stedet kommer eggene for å lage virusvaksiner fra kyllinger som oppbevares på spesielle gårder under kontrollerte forhold. De må oppfylle meget høye kvalitetsstandarder og være helt fri for andre patogener ("sterilt kyllingoppdrett").
Produksjonen av eggbaserte vaksiner er påvist, men også tidkrevende: det kan ta seks til tolv måneder før produksjonsprosessen er fullført. I tillegg kreves enorme mengder av spesialeggene for vaksineproduksjon - om enn bare for influensavaksinen, som nesten utelukkende lages på denne måten. Rundt om i verden kreves det rundt en halv milliard høneegg for dette hvert år. Fordi for en enkelt dose influensavaksine trenger du ett eller to egg.
Cellekulturer
Virus for vaksineproduksjon kan skaffes raskere og mer effektivt fra dyrecelle- eller vevskulturer. De kommer fra aper, hamstere, hunder eller menneskefoster. Det er også cellelinjer som har blitt genetisk udødeliggjort i laboratoriet og dermed kan brukes på lang sikt for dyrking av vaksinevirus.
For helautomatisk produksjon i stor skala har forskere utviklet teknikker for å dyrke cellelinjene i store beholdere (gjærere eller bioreaktorer) - som flyter i et flytende medium som alle stoffer tilsettes kontinuerlig som cellene trenger for å overleve og dele seg.
Ansatte bruker sonder til å overvåke næringsstofftilførselen og om nødvendig justere den til det økende antallet celler. Spesielle pumper filtrerer kontinuerlig ut celleavfallsprodukter og brukte næringsoppløsning. Så snart en viss celletetthet er nådd, legges virusene som kreves for en vaksine til. De infiserer cellene, noe som gjør at de kan formere seg i store mengder.
Å dyrke virus i cellekulturer i stedet for kyllingegg har en annen fordel i tillegg til kortere produksjonstid: Tilsvarende vaksiner er garantert fri for kyllingprotein og passer derfor også for personer som er allergiske mot kyllingprotein. For eksempel er det cellekulturbaserte influensavaksiner.
Genteknologi
Patogener trenger ikke alltid å multipliseres for å kunne produsere en vaksine fra dem. Når forskere har dechiffrert den genetiske planen til antigenene sine, kan denne eller deler av den gjenskapes i laboratoriet ved hjelp av gentekniske metoder. De kunstig produserte tegningene smugles inn i for eksempel bakterier eller gjærceller, som deretter produserer de fremmede antigenene. Slike "rekombinante vaksiner" er tilgjengelige mot herpes zoster (helvetesild), hepatitt B og humant papillomavirus (HPV).
Eller forskere kan bruke den til å få planen for ønsket antigen, som skal slå på immunsystemet i menneskekroppen etter vaksinasjonen. Om nødvendig blir disse konstruksjonsplanene viderebehandlet (f.eks. Oppnådd genetisk DNA blir oversatt til messenger -RNA) og "pakket". Små fettdråper brukes til dette, eller DNA / RNA -biter kanaliseres inn i ufarlige bærervirus (vektorer). Denne "emballasjen" er viktig fordi de genetiske tegningene er veldig følsomme og raskt brytes ned.
Opptak og sikkerhet
Godkjenningen av en ny vaksine er strengt regulert og kontrollert. Produsenten må levere mange dokumenter om sikkerhet og effektivitet av det nye legemidlet til vedkommende myndighet (se nedenfor: Vaksinasjonsmyndigheter). Disse inkluderer først og fremst:
- Data om kvaliteten på vaksinen med hensyn til produksjonsprosessen og tilhørende kvalitetssikrings- og kontrolltiltak
- Data om preklinisk testing av vaksinen på dyr
- Data om effektiviteten og bivirkningene av vaksinen som finnes i kliniske studier hos mennesker
Det er presise retningslinjer for kvalitetssikring av produksjonsprosesser og miljø for vaksiner og andre legemidler. Denne "Good Manufacturing Practice" (GMP) inkluderer en dokumentasjon av alle arbeidstrinn samt en regelmessig gjennomgang av laboratorier, enheter, leverandører og råvarer.
Lisensmyndigheten gjennomgår og vurderer alle innsendte dokumenter og avgjør deretter om den nye vaksinen skal godkjennes eller ikke. Du kan finne ut mer om godkjenningsprosedyrene for legemidler i vår artikkel "Godkjenning for legemidler".
Overvåking etter godkjenning
Selv etter at den er godkjent, holder myndighetene øye med en vaksine. I Tyskland er Paul Ehrlich Institute (PEI; se nedenfor) ansvarlig for dette. Den vurderer kvaliteten, effektiviteten og sikkerheten til hver batch vaksine. Bare hvis ekspertene ikke har noe å klage på, blir partiet utgitt for markedet.
I tillegg er leger forpliktet til å rapportere eventuelle uforutsette bivirkninger av en vaksinasjon til PEI. Det er mulig at svært sjeldne bivirkninger eller langtidseffekter av vaksinasjonen ikke ble registrert i de kliniske godkjenningsstudiene. På grunnlag av de rapporterte bivirkningene kan PEI om nødvendig be om ytterligere advarsler fra produsenten i pakningsvedlegget, be om tilbakekalling av en individuell vaksinepakke eller fullstendig tilbakekalle godkjenningen for vaksinen.
Vaksinasjonsmyndighetene
En ny vaksine må overvinne mange hindringer og oppfylle strenge sikkerhetsforskrifter før leger kan administrere disse menneskene. Av denne grunn ble det opprettet en kontrollmyndighet i Tyskland for over 100 år siden for å ta seg av testing og godkjenning av vaksiner: Paul Ehrlich Institute (PEI) i Langen nær Frankfurt am Main.
Det jobber tett med European Medicines Agency (EMA) med base i Amsterdam. I dette landet tar Standing Vaccination Commission (STIKO) ved Robert Koch Institute seg av risiko-nyttevurderingen av en vaksinasjon og vaksinasjonsanbefalinger.
Paul Ehrlich Institute (PEI)
Paul Ehrlich Institute er tildelt det føderale helsedepartementet. Den overvåker alle vaksiner og biomedisinske legemidler (f.eks. Terapeutiske antistoffer, blod- og vevspreparater, legemidler for genterapi).
Følgende oppgaver faller inn under ansvarsområdet til PEI:
- Godkjenning av kliniske studier av vaksiner
- Behandling av godkjenningssøknader for nye vaksiner samt oppfølgingssøknader og begjærte endringer i eksisterende godkjenninger
- Statlig testing og godkjenning av vaksinepartier
- Evaluering av legemiddelsikkerhet (innsamling og vurdering av bivirkninger rapportert av leger)
- Forskning innen allergologi, bakteriologi, bioteknologi, immunologi, hematologi, transfusjonsmedisin, veterinærmedisin og virologi
- Rådgivning av nasjonale, europeiske og internasjonale organer om risikovurdering og utvikling av retningslinjer
European Medicines Agency (EMA)
EU Medicines Agency (European Medicines Agency) har lignende oppgaver på europeisk nivå som Paul Ehrlich Institute i Tyskland. En av hovedoppgavene er å godkjenne og overvåke legemidler i EU - ikke bare vaksiner og biomedisinske legemidler, men også andre legemidler. I tillegg, i likhet med PEI, samler EMA inn rapporter om bivirkninger som oppstår. I tillegg kan det - om nødvendig - trekke godkjenningen av et stoff eller be om forbedringer fra produsenten.
EMA jobber tett med nasjonale reguleringsmyndigheter i EU -land - så vel som med Generaldirektoratet for helse i EU -kommisjonen og med søsterbyråer som European Center for Disease Prevention and Control (ECDC).
Stående vaksinasjonskommisjon (STIKO)
Når og hvordan vaksinasjoner skal administreres, er i stor grad avhengig av vaksinasjonsanbefalinger fra Standing Vaccination Commission (STIKO) ved Robert Koch Institute. STIKO publiserer for eksempel vaksinasjonskalendere for alle aldersgrupper. Den anbefaler ikke individuelle vaksiner, men vurderer i utgangspunktet for hvilke sykdommer en vaksinasjon kan være fornuftig - og for hvem.
STIKO -anbefalingene er i utgangspunktet ikke juridisk bindende. Hvis Federal Joint Committee (G-BA) godkjenner vurderingen, er den anbefalte vaksinasjonen inkludert i katalogen over obligatoriske fordeler ved den lovpålagte helseforsikringen.
I likhet med Paul Ehrlich Institute og European Medicines Agency, er Standing Vaccination Commission også involvert i å registrere uventede bivirkninger - selv om det bare er indirekte. STIKO utvikler kriterier for å skille vanlige vaksinasjonsreaksjoner (f.eks. Rødhet i huden) fra alvorlige hendelser. Videre gir STIKO råd om hvordan du skal håndtere flaskehalser for vaksine, dvs. mangel på vaksiner.
Vaksiner: Ny utvikling
Vaksiner er i dag godkjent mot rundt 30 sykdommer. I noen tilfeller jobber farmasøytiske selskaper med enda bedre vaksiner mot noen av disse sykdommene. Nye vaksiner mot pneumokokker er i arbeid som skal beskytte mot enda flere undertyper av bakteriepatogenet enn tidligere tilgjengelige pneumokokkvaksiner.
I tillegg forskes det på helt nye vaksiner - det vil si vaksiner mot sykdommer som ennå ikke er vaksinert mot, for eksempel AIDS. Forskere jobber også med en vaksine mot norovirus. Disse patogenene er hyppige utløsere for gastrointestinale infeksjoner med diaré og oppkast over hele verden.
Forskere forsker også intensivt på nye prosesser som muliggjør raskere og mer effektiv vaksineproduksjon. Fokuset her er på de genbaserte vaksinene som er nevnt ovenfor. Som en del av korona -pandemien godkjente myndighetene vaksiner av denne nye generasjonen for første gang (vaksinasjon mot koronavirus).
Sist, men ikke minst, er også terapeutiske vaksiner gjenstand for forskning. Målet er ikke å forhindre en sykdom, men å behandle den - for eksempel livmorhalskreft forårsaket av HPV. Forskere ønsker også å bringe terapeutiske vaksiner til markedet. Mot HIV, for eksempel, skal de "presse" pasientens immunsystem slik at det kan holde virusene under kontroll.
Tags.: forebygging narkotika laboratorieverdier